HUKUM KEKEKALAN MASSA (HUKUM LAVOSIER)
LAVOSIER menyimpulkan bahwa :jika suatu reaksi kimia dilakukan di ruang tertutup,sehingga tidak ada zat" yang hilang,maka
"massa zat sebelum dan sesudah reaksi adalah sama(tetap)
contoh:
dalam tabung tertutup ditimbang 32 gram belerang dan 63,5 gram
tembaga. Setelah dicampur lalu dipanaskan dalam tabung tertutup dan
reaksi berjalansempurna maka terjadi zat baru, yaitu tembaga ( II )
sulfida. Berapa massa zat baru tersebut ?
jawab :

ternyata massa zat baru tersebut sama dengan massa total zat-zat sebelum reaksi.
Bunyi Hukum Kekekalan Massa : ” JUMLAH MASSA ZAT-ZAT SEBELUM DAN SESUDAH REAKSI ADALAH SAMA ”
HUKUM PERBANDINGAN TETAP(PROUST)
bunyi hukum perbandingan tetap
"DALAM SUATU SENYAWA,PERBANDINGAN MASSA UNSUR-UNSUR PENYUSUNYA SELALU TETAP"
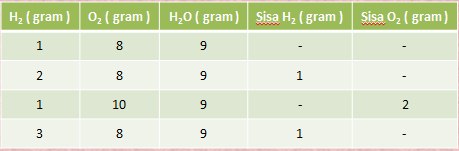
Pada percobaan 1 gram hidrogen dicampur dengan 8 gram oksigen
hasilnya ialah 9 gram air. Dan ternyata 8 gram oksigen hanya dapat
bereaksi dengan 1 gram hidrogen saja.
Data Percobaan Hidrogen dan Oksigen
contoh soal :
Jika kita mereaksikan 4 gram hidrogen dengan 40 gram oksigen, berapa gram air yang terbentuk?
jawab
perbandingan massa hidrogen dan oksigen adalah 1:8
perbandingan massa hidrogen dan oksigen yang di campurkan adalah 4:40
maka 4 gram hidrogen yang diperlukan yaitu 4x8 gram ooksigen yaitu 32 gram
untuk kasus ini oksigen yang di campurkan tidak bereaksi semuanya,oksigen masih bersisa sebanyak(40-32=8 gram).nah,sekarang kita akan menghitung berapa gram air yang terbentuk dari 4 gram hidrogen dan 32 gram oksigen?
H2 + O2 -----> H2O
perbandingan massa 1 gram 8 gram 9 gram
jika awal reaksi 4 gram 40 gram gram?
yang bereaksi 4 gram 32 gram 36 gram
jadi oksigen masih bersisa sebesar 8 gram.
HUKUM PERBANDINGAN BERGANDA ( HUKUM DALTON )
” Bila unsur-unsur dapat membentuk dua macam senyawa atau lebih,
dimana massa salah satu unsur tersebut tetap (sama), maka perbandingan
massa unsur yang lain dalam senyawa-senyawa tersebut merupakan bilangan
bulat dan sederhana ”
 HUKUM PERBANDINGAN VOLUME ( HUKUM GAY LUSSAC )
HUKUM PERBANDINGAN VOLUME ( HUKUM GAY LUSSAC )
” Pada temperatur dan tekanan yang sama,
perbandingan volume gas-gas yang bereaksi dan volume gas hasil reaksi
merupakan perbandingan bilangan bulat dan sederhana “
Pada reaksi zat yang wujudnya gas, perbandingan koefisien reaksi ekuivalen dengan perbandingan volume jika reaksi tersebut
dilakukan pada temperatur dan tekanan yang sama.

jawab :
HIPOTESIS AVOGADRO
” gas-gas yang volumenya sama, jika diukur pada temperatur dan tekanan yang sama, mengandung jumlah molekul yang sama pula ”
Avogadro menjelaskan percobaan Gay Lussac dengan menganggap partikel –
partikel gas tidak sebagai atom-atom, tetapi sebagai molekul-molekul

Perbandingan volume gas-gas yang bereaksi dan gas-gas hasil reaksi jika diukur pada temperatur dan tekanan yang sama
akan sesuai dengan perbandingan jumlah molekulnya, akan sama dengan perbandingan koefisien reaksinya
Contoh Soal :
gas hidrogen direaksikan dengan gas oksigen
membentuk 8 liter ( T,P ) uap air. berapa liter gas hidrogen dan gas
oksigen dibutuhkan pada reaksi tersebut ?